KOMPAS.com - Kandidat vaksin siap pakai dari perusahaan biofarmasi asal China, Sinovac, akhirnya tiba di Indonesia, pada Minggu (6/12/2020) malam.
Berdasarkan tayangan video yang disiarkan kanal youtube Sekretariat Presiden, sebanyak 1,2 juta dosis vaksin dari Cina yang diangkut menggunakan Pesawat Garuda Boeing 777-300 itu mendarat di Bandara Soekarno-Hatta, Tangerang, Banten, sekitar pukul 21.30 WIB.
Dalam tayangan terpisah, Presiden Joko Widodo menuturkan, sebanyak 1,2 juta dosis vaksin Sinovac merupakan vaksin siap suntik. Jokowi juga mengatakan, nantinya akan ada 1,8 juta dosis vaksin siap suntik yang tiba di Indonesia pada Januari 2021.
Selain itu juga akan tiba 45 juta dosis bahan baku curah untuk pembuatan vaksin Covid-19. Sebanyak 45 juta dosis bahan baku itu akan tiba di Indonesia dalam dua tahapan.
Baca juga: 1,2 Juta Dosis Vaksin Covid-19 Buatan Sinovac Tiba di Indonesia
Tahap pertama sebanyak 15 juta dosis dan tahap kedua 30 juta dosis.
"Selanjutnya diproses lebih lanjut oleh Bio Farma. Kita akan bersyukur Alhamdulillah vaksin sudah tersedia artinya kita bisa segera mencegah meluasnya wabah covid-19,” tutur dia.
"Tapi untuk memulai vaksinasi masih memerlukan tahapan-tahapan dari BPOM (Badan Pengawas Obat dan Makanan)," ucap Jokowi.
Untuk lebih memahami kandidat vaksin yang baru saja tiba di Indonesia, berikut beberapa hal yang perlu diketahui terkait vaksin CoronaVac yang dikembangkan Sinovac China.
Apa kandungan kandidat vaksin Sinovac?
Kandidat vaksin Covid-19 yang dikembangkan Sinovac dinamai CoronaVac.
Dilansir Nature, Rabu (2/12/2020), vaksin Sinovac dibuat dengan menggunakan teknologi inactivated virus atau virus yang tidak aktif lagi. Teknologi ini memungkinkan vaksin dikembangkan lebih cepat.
Dengan menggunakan inactivated virus, pembuatannya banyak menggunakan partikel virus yang dimatikan untuk dapat memicu sistem kekebalan tubuh terhadap virus tanpa menimbulkan respons penyakit yang serius.
Selain itu, vaksin inactivated virus juga memungkinkan vaksin lebih mudah disimpan di lemari es dengan standar suhu 2-8 derajat Celsius dan dapat bertahan hingga tiga tahun.
Hal ini merupakan salah satu keuntungan yang ditawarkan Sinovac agar bisa didistribusikan ke wilayah-wilayah yang tidak bisa menyimpan di rantai dingin (cold-chain).
Cold-chain atau rantai dingin menunjukkan serangkaian tindakan atau peralatan yang diterapkan untuk mempertahankan suatu produk dalam suhu rendah hingga dikonsumsi.
Cold-chain dalam vaksin berupa lemari es dan freezer khusus untuk menyimpan vaksin dan termos (vaksin carrier) untuk membawa vaksin ke tempat pelayanan.
"Perkiraan tersebut diekstrapolasi dari fakta bahwa vaksin tetap aman saat diterima dalam jangka waktu 42 hari jika disimpan di suhu 25 derajat Celsius, 28 hari pada 37 derajat Celsius, dan lima bulan untuk suhu 2-8 derajat Celsius," kata Liu Peicheng, juru bicara Sinovac seperti dilansir Reuters, Senin (7/9/2020).
 Vaksin Covid-19 Sinovac tiba di Indonesia pada Minggu (6/12/2020). Vaksin diterbangkan dari Beijing, Cina dan mendarat di Bandara Soekarno-Hatta, Tangerang, Banten, sekitar pukul 21.30 WIB
Vaksin Covid-19 Sinovac tiba di Indonesia pada Minggu (6/12/2020). Vaksin diterbangkan dari Beijing, Cina dan mendarat di Bandara Soekarno-Hatta, Tangerang, Banten, sekitar pukul 21.30 WIBBagaimana hasil riset vaksin Sinovac?
CoronVac, vaksin Covid-19 buatan Sinovac sejauh ini masih dalam fase tiga atau tahap terakhir uji klinis.
Dalam publikasi terakhir yang dipublikasikan di jurnal ilmiah The Lancet edisi 17 November 2020, baru melampirkan hasil dari fase I dan II.
Menurut laporan itu, Coronavac memicu respons kekebalan dengan cepat, meski penelitian yang dilakukan pada April hingga Mei tahun ini tidak memberikan presentase yang jelas terkait tingkat keberhasilan vaksin.
Dilansir BBC, (18/11/2020), Zhu Fengcai, salah satu penulis makalah tersebut mengatakan bahwa hasil didasarkan pada 144 peserta dalam uji coba fase 1 dan 600 peserta dalam uji coba fase 2. Pihaknya hanya mengatakan vaksin cocok untuk penggunaan darurat.
Belum ada data dari uji coba fase 3 skala besar yang sedang berlangsung yang telah dipublikasikan.
Uji coba tahap akhir atau fase III dari vaksin Sinovac sedang dilakukan di Pakistan, Arab Saudi, Rusia, Brasil, dan Indonesia.
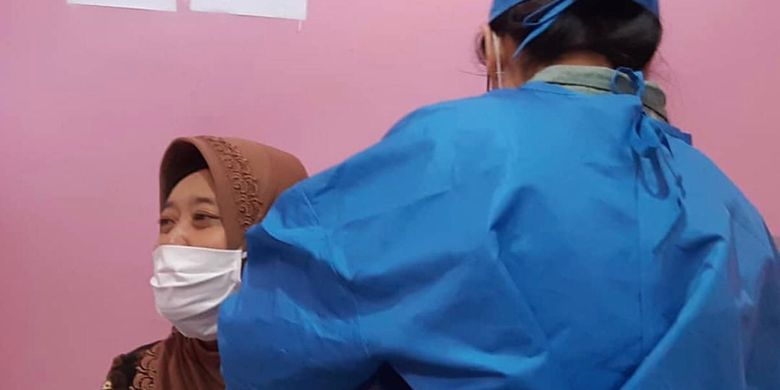 Dosen Unpad, Herlina Agustin saat sedang disuntik vaksin Covid-19 dari Sinovac, China.
Dosen Unpad, Herlina Agustin saat sedang disuntik vaksin Covid-19 dari Sinovac, China. Bagaimana perkembangan vaksin Sinovac di Indonesia?
Sebagai informasi, uji klinik vaksin Sinovac di Indonesia merupakan uji klinik fase 3.
Pengujian ini telah dilaksanakan oleh Tim Peneliti Fakultas Kedokteran Universitas Padjajaran melalui kerjasam PT Biofarma dengan Sinovac Biotech China.
Hingga saat ini, sebanyak 1.620 subjek uji klinik telah menerima suntikan pertama vaksin (hari ke-0) dan 1.603 subjek telah menerima suntikan kedua (hari ke-14).
Ketua Komnas Komite Nasional Pengkajian Kejadian Ikutan Paska Imunisasi (KIPI), Prof Dr Hindra Irawan Satari dr SpA(K) mengatakan, sejauh ini perkembangan uji fase 3 vaksin SinoVac hasilnya baik.
"Di Bandung, dari 1600-an (1620 subjek) yang diberikan vaksin (SinoVac), tidak ada yang mengalami efek samping serius," kata Hindra Dalam konferensi pers terkait perkembangan uji klinik vaksin Covid-19, Kamis (19/11/2020).
"Tetapi ini (uji klinik vaksin Covid-19) akan terus dikaji, karena pengkajian belum usai," imbuhnya.
Baca Selengkapnya: Uji Klinik Vaksin Covid-19 Sinovac di Bandung, Bagaimana Perkembangannya?
 Tampilan vaksin corona yang dikembangkan perusahaan farmasi asal Cina, Sinovac.
Tampilan vaksin corona yang dikembangkan perusahaan farmasi asal Cina, Sinovac.Apa bisa langsung dierdarkan?
Kepala Badan Pengawas Obat dan Makanan ( BPOM), DR Penny K Lukito MCP mengatakan bahwa izin edar vaksin ini baru bisa dikeluarkan pada minggu ketiga atau keempat bulan Januari 2021 mendatang.
"Kerjasama bersama (berbagai pihak terkait) untuk menuju ekspektasi kita ke depan adalah pemberian EUA pada minggu ke-3 atau ke-4 bulan Januari (2021)," kata Penny dalam konferensi pers terkait perkembangan uji klinik vaksin Covid-19, Kamis (19/11/2020).
Berikut perjalanan vaksin Sinovac agar bisa mendapatkan izin edar setelah melakukan uji klinik fase 3 di Bandung.
1. Pengamatan 1.620 subjek
Dalam prosesnya, setelah penyuntikan vaksinasi terhadap 1.620 subjek, akan dilakukan pengamatan terhadap khasiat dan keamanan vaksin tersebut.
Pengamatan dilakukan mulai dari setelah pemberian suntikan pertama hingga 6 bulan sesudah pemberian suntikan kedua.
Pengamatan juga dilakukan sekaligus terhadap kemungkinan terjadinya Kejadian Tidak Diinginkan (KTD) pasca imunisasi.
 Petugas mengecek kontainer berisi vaksin COVID-19 saat tiba di Bandara Soekarno-Hatta, Tangerang, Banten, Minggu (6/12/2020). Sebanyak 1,2 juta dosis vaksin COVID-19 buatan perusahaan farmasi Sinovac, China, tiba di tanah air untuk selanjutnya akan diproses lebih lanjut ke Bio Farma selaku BUMN produsen vaksin.
Petugas mengecek kontainer berisi vaksin COVID-19 saat tiba di Bandara Soekarno-Hatta, Tangerang, Banten, Minggu (6/12/2020). Sebanyak 1,2 juta dosis vaksin COVID-19 buatan perusahaan farmasi Sinovac, China, tiba di tanah air untuk selanjutnya akan diproses lebih lanjut ke Bio Farma selaku BUMN produsen vaksin.2. Pemenuhan syarat keamanan, khasiat dan mutu
Penny menjelaskan, untuk dapat diterbitkan persetujuan penggunaan atau izin edar, vaksin harus memenuhi persyaratan keamanan, khasiat dan mutu sesuai standar yang telah ditetapkan.
Data khasiat dan keamanan diperoleh dari hasil uji klinik, sementara data mutu diperoleh dari pemenuhan spesifikasi produk vaksin dari bahan awal hingga produk jadi.
Untuk memastikan pemenuhan persyaratan khasiat dan keamanan vaksin tersebut, Badan POM terus melakukan pengawalan pelaksanaan uji klinik.
Pengawalan dilakukan mulai dari percepatan proses evaluasi dalam rangka pemberian Persetujuan Protokol Uji Klinik (PPUK), hingga pelaksanaan inspeksi untuk memastikan pelaksanaan uji klinik sesuai dengan protokol uji klinik yang disetujui dan ketentuan pelaksanaan Cara Uji Klinik yang Baik (CUKB) atau Good Clinical Practice.
Penny menambahkan, pemantauan terhadap keamanan subjek uji klinik juga dilakukan oleh Komite Etik Penelitian Kesehatan Universitas Padjajaran.
"Dari hasil inspeksi yang dilakukan, sejauh ini uji klinik telah dilaksanakan dengan baik. Belum ada KTD atau efek samping serius yang dialami oleh subjek uji klinik," jelas Penny.
3. Perlu dukungan data mutu vaksin
Untuk mendukung data mutu uji klinik vaksin Sinovac, Badan POM telah melakukan inspeksi ke fasilitas produksi Sinovac Life Science Beijing pada tanggal 2 hingga 5 November 2020.
Inspeksi dilakukan secara komprehensif untuk memastikan produsen menerapkan standar Cara Pembuatan Obat yang Baik (CPOB) secara konsisten di sepanjang proses pembuatan vaksin, mulai dari pembuatan bahan baku vaksin (upstream), formulasi vaksin (downstream), hingga proses pengisian ke dalam vial menjadi produk jadi.
4. Proses evaluasi
Setelah data keamanan, khasiat dan mutu vaksin tersebut disampaikan oleh industri fasmasi kepada Badan POM, maka akan dilakukan proses evaluasi yang mengacu pada standar pedoman evaluasi nasional dan internasional.
Proses evaluasi ini dilakukan oleh BPOM melalui pembahasan bersama Komite Nasional Penilai Obat, tenaga ahli dan klinisi dari Ikatan Dokter Indonesia.
Penny mengatakan, khusus untuk evaluasi vaksin, pembahasan dilakukan bersama Indonesia Technical Advisory Group on Immunization (Itagi).
"Kami berharap agar PT Biofarma dan Sinovac Biotech China berkomitmen untuk memenuhi data-data tersebut, sehingga pemberian izin dapat segera dilakukan oleh Badan POM sesuai dengan rencana vaksinasi yang ditetapkan oleh pemerintah," jelas Penny.
Baca selengkapnya: BPOM Ungkap Proses Vaksin Covid-19 Sinovac untuk Dapat Izin Edar
Bagaimana bisa diterbitkan Emergency Use Authorization (EUA)?
Penny menuturkan, mengingat kebutuhan akan vaksin yang mendesak di masa pandemi ini, Badan POM memberikan fleksibilitas terkait penerbitan izin edar vaksin Covid-19 melalui simplifikasi prosedur dan persyaratan, tanpa mengabaikan aspek keselamatan manusia dan kualitas vaksin.
Dalam hal ini, izin dikeluarkan dalam bentuk perizinan penggunaan vaksin dalam kondisi darurat atau Emergency Use Authorization (EUA).
Sementara itu, syarat pemberian EUA adalah vaksin harus sudah memiliki data uji klinik fase 1 dan uji klinik fase 2 secara lengkap, serta data analisis interim uji klinik fase 3 untuk menunjukkan khasiat dan keamanan.
Prosedur EUA ini mengacu pada pedoman persetujuan emergensi dari WHO (WHO Emergency Listing), US Food and Drug Administration (EUA), dan European Medicines Agency/EMA (Conditional Approval).
https://news.google.com/__i/rss/rd/articles/CBMihQFodHRwczovL3d3dy5rb21wYXMuY29tL3NhaW5zL3JlYWQvMjAyMC8xMi8wNy8xMDMxMDA3MjMvNS1oYWwtc29hbC12YWtzaW4tc2lub3ZhYy15YW5nLXRpYmEtc2VtYWxhbS1kYXJpLWlzaS1oaW5nZ2EtaXppbi1lZGFyP3BhZ2U9YWxs0gF8aHR0cHM6Ly9hbXAua29tcGFzLmNvbS9zYWlucy9yZWFkLzIwMjAvMTIvMDcvMTAzMTAwNzIzLzUtaGFsLXNvYWwtdmFrc2luLXNpbm92YWMteWFuZy10aWJhLXNlbWFsYW0tZGFyaS1pc2ktaGluZ2dhLWl6aW4tZWRhcg?oc=5
2020-12-07 03:31:00Z
Tidak ada komentar:
Posting Komentar